Mercúrio
Nas células: o mercúrio pode ligar-se a uma variedade de sistemas enzimáticos, incluindo os existentes nos microssomas e mitocôndria, produzindo um dano celular não especifico ou mesmo morte celular. [14][10]
Tem particular afinidade para ligandos contendo grupos sulfidrilo, fosforilo, carboxilo e amida, provocando a inibição ou ativação de enzimas:
Outros mecanismos: Atua também por outros mecanismos como a geração de stress oxidativo, interrupção da formação dos microtúbulos e da síntese proteica e de DNA, e mecanismos de resposta auto-imune. [10][14]
Mecanismo de Toxicidade
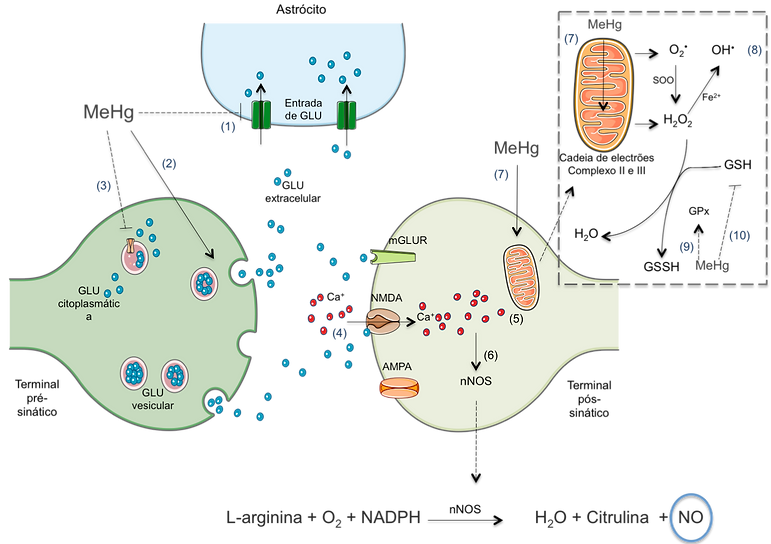
Ação neurotóxica: O mercúrio apresenta uma importante ação neurotóxica (fig 1), que resulta da interação com proteínas contendo –SH e –SeH (recetores de neurotransmissores, transportadores, enzimas antioxidantes) e com GSH e cisteína.
O metilmercúrio provoca uma desregulação da homeostasia do cálcio e glutamato levando a stress oxidativo. Causa um aumento dos níveis de glutamato extracelular por inibição da captação de glutamato pelos astrócitos (evento 1), estimulação da libertação de glutamato pelos terminais pré-sináticos (evento 2) e inibição do uptake de glutamato (evento 3). Este aumento de glutamato extracelular provoca uma sobrestimulação dos recetores de glutamato NMDA aumentando o influxo de cálcio para os neurónio (evento 4). Os níveis aumentados de cálcio intracelular leva a um colapso da mitocôndria (evento 5), que ativa a oxido nítrico sintetase (nNos) (evento 6) levando a um aumento do óxido nítrico. O metilmercúrio afeta a cadeia transportadora de eletrões mitocondrial principalmente por inibição do complexo II-III (evento 7) levando à formação de anião superóxido (O2.-) e peróxido de hidrogénio (H2O2). O peróxido de Hidrogénio pode produzir o anião radical hidroxilo(• OH) via Reação de Fenton (evento 8). O aumento de H2O2 induzido pelo metelmercúrio pode ter como consequência uma diminuição da atividade da glutationa peroxidase (GPx) (evento 9) e depleção de glutationa (GSH) (evento 10). [11]
Figura 1. Espécies reativas como mediadores da neurotoxicidade induzida pelo metilmercúrio [11]
Imagem adaptada [11]

Inativa sistemas enzimáticos microssomais e mitocondriais, transportadores e de proteínas estruturais, levando à inibição do metabolismo do piruvato, da desidrogenase de lactato e da síntese de ácidos gordos [14][10]
Ativa enzimas hidrolíticas dos lisossomas provocando destruição celular [14][10]
O metilmercúrio é a forma mais importante em termos de toxicidade e efeitos adversos em termos de saúde por exposição ambiental. O principal efeito adverso da exposição ao metilmercúrio em adultos é o efeito neurotóxico.[10]

Referências:
[10] Casarett and Doull's Toxicology: The Basic Science of Poisons
[11] Marcelo Farina A. ,et al, "Oxidative stress in MeHg-induced neurotoxicity", Toxicology and Applied Pharmacology 256 (2011) 405–417
[12] S. Agrawal, et al, "Comparative oxidative stress, metallothionein induction and organ toxicity following chronic exposure to arsenic, lead and mercury in rats", Cell. Mol. Biol. 2014; 60 (2): 13-21
[13] Vicente Rodilla, et al, "Exposure of cultured human proximal tubular cells to cadmium, mercury, zinc and bismuth: toxicity and metallothionein induction", Chemico-Biological Interactions 115 (1998) 71–83
[14] Jeffrey S Gaffney, et al, "In-depth review of atmospheric mercury: sources, transformations, and potential sinks", Browse Journals: Energy and Emission Control Technologies, Volume 2, 6 August 2014 Volume 2014:2 Pages 1-21
[23] Z Yin,, et al, The methylmercury-L-cysteine conjugate is a substrate for the L-type large neutral amino acid transporter, LAT1, J Neurochem. Author manuscript; available in PMC 2009 Nov 1.
Como mecanismo de adaptação à toxicidade do mercúrio podem estar envolvida a sobre-expressão de metalotioneína e genes relacionados com a homeostasia da glutationa, uma vez que a administração de mercúrio inorgânico em animais induz a síntese renal de metalotioneína, que participa na destoxificação do mercúrio [12][13]
Como o nosso organismo se protege desta toxicidade?

O metilmercúrio (MeHg) apresenta uma elevada afinidade para os grupos tiol (-SH), sendo então que a maioria do metilmercúrio nos tecidos se encontra conjugada com moléculas contendo sulfidrilo solúveis em água, principalmente L-cisteína, glutationa (GSH), hemoglobina, albumina e outros polipéptidos contendo grupos tiol. Os conjugados de MeHg-L-cisteína são estruturalmente semelhantes ao aminoácido L-metionina. A L-metionina é um substrato endógeno do transportador de aminoácidos neutros de grande dimensão L (LAT1), possuindo uma constante de afinidade elevada para o transportador. Assim o metilmercúrio quando conjugado com a L-cisteina consegue utilizar estes transportadores
O LAT1 é provavelmente um dos principais sistemas de transporte de nutrientes na barreira hemato-encefálica, sendo altamente expresso nas células endoteliais capilares do cérebro. De acordo com seu papel crucial no transporte de aminoácidos essenciais durante o desenvolvimento do cérebro, os níveis de mRNA de LAT1 na barreira hemato-encefálica são particularmente altos durante o período pré-natal.
Assim explica-se a grande ação neurotóxica do metilmercúrio, principalmente nos cérebros em desenvolvimento. [22]
Como consegue o metilmercúrio atravessar a barreira hemato-encefálica?